7.1. Ķīmisko reakciju ātrums
Ķīmiskās reakcijas norit ar dažādu ātrumu. Dzelzs rūsēšana notiek lēni, bet vielu degšana, piemēram, magnija degšana – ātri. Ķīmisko reakciju ātrumu nosaka, mērot reakcijas izejvielu vai produktu koncentrācijas maiņu laika vienībā:
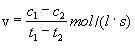 jeb
jeb
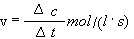
kur
c1 un
c2 - reaģējošās vielas koncentrācija attiecīgi laika posma sākumā un beigās,
mol/
l;
t1 un t2 – laiks, s.
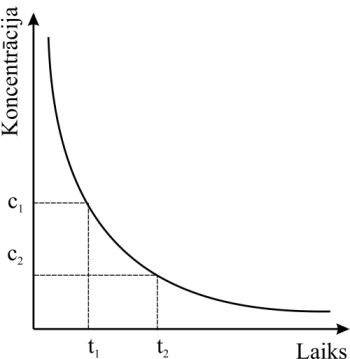
1. att. Ķīmiskās reakcijas izejvielas koncentrācijas maiņa laika posmā
Ķīmiskās reakcijas ātrums var mainīties atkarībā no reakcijas apstākļiem un citiem faktoriem.
Ķīmiskās reakcijas ātrumu ietekmē: