7.3. Ķīmisko reakciju norise tehnoloģiskajos procesos
Ķīmisko reakciju norises optimālo apstākļu noskaidrošana ir svarīgs vielu rūpnieciskas ražošanas faktors. Tā dod iespēju ekonomēt izejvielas un energoresursus vielu ražošanas procesā, kā arī iekārtu celtniecības un ekspluatācijas izmaksas.
Reakcijas apstākļus izvēlas tā, lai vienā laika vienībā iegūtais produkta daudzums būtu pēc iespējas lielāks.
4.att.
Amonjaku rūpnieciski iegūst no slāpekļa un ūdeņraža ar F. Hābera metodi.
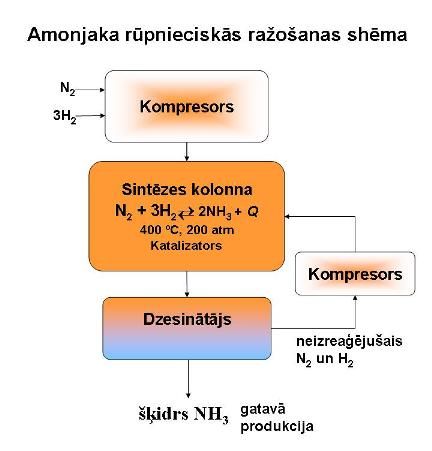
5.att.
Rūdu sasmalcina.
Oksidēšanas procesa ātrumu palielina, gaisu aizstājot ar skābekli. Izvēlas optimālu oksidēšanas procesa temperatūru.
Nodrošina nepārtrauktu krāsns darbību.
No SO2 atdala katalizatoram kaitīgos putekļus.
Ar koncentrētu sērskābi saista nevēlamos ūdens tvaikus.
Lietderīgi izmanto produktu siltumu – sasilda izejvielu SO2.
SO2 oksidēšanai par SO3 izmanto katalizatoru V2O5, tas dod iespēju samazināt reakcijas temperatūru un spiedienu.
Sērskābes miglas veidošanos novērš, SO3 saistot nevis ar ūdeni, bet ar sērskābi.
Tas nodrošina nepārtrauktu sērskābes ražošanas procesu.
Slāpekli iegūst destilējot gaisu.
Ūdeņradi iegūst naftas produktu šķelšanas gaitā vai no metāna.
Slāpekli un ūdeņradi sajauc tilpumu attiecībā 1 : 3 un gāzu maisījumu saspiež. Spiediena palielināšana nobīda reakcijas līdzsvaru produkta veidošanās virzienā. Reakciju veic 20 MPa (200 atm) spiedienā.
Reakcija notiek virs katalizatora – līdz 350 - 500 °C temperatūrai sakarsētas dzelzs. Temperatūras samazināšana nobīda reakcijas līdzsvaru produkta veidošanās virzienā.
N2 + 3H2 2 NH3 + Q
Gāzu maisījumu atdzesē, līdz amonjaks sašķidrinās, un to atdala. Neizreaģējušo H2 un N2 atkal vada pār katalizatoru.