5.3. Neorganisko vielu pārvērtības dabā
Arī dabā visu laiku noris vielu pārvērtības – ķīmiskās reakcijas; notiek vielu un ķīmisko elementu aprite jeb riņķojums. Tie ir savstarpēji saistīti, apgriezeniski procesi, kuros ķīmiskais elements no gaisa pāriet augsnē vai ūdenī un no turienes – atpakaļ gaisā.
Slāpekļa aprite dabā
Augi un dzīvnieki gaisa slāpekli uzņemt nevar, taču to spēj saistīt augsnes baktērijas, kā arī gumiņbaktērijas, kas mājo uz tauriņziežu (āboliņa, zirņu, lupīnas u. c.) saknēm. Tās gaisa slāpekli pārvērš amonija sāļos. Nitrificējošo baktēriju darbības rezultātā augsnē veidojas slāpekļskābe. Nedaudz slāpekļskābes veidojas negaisa laikā un tādējādi kopā ar lietu nonāk augsnē.
N2 + O2
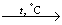 2NO
2NO
2NO + O2 → 2NO2
4NO2 + 2H2O + O2
→ 4HNO3
Ūdenī šķīstošos amonija sāļus un nitrātus augi uzņem ar sakņu sistēmu un sintezē aminoskābes un olbaltumvielas. Dabā procesi, kuros augsnē nonāk slāpeklis, līdzsvarojas ar tiem procesiem, kas izraisa slāpekļa zudumu. Olbaltumvielām trūdot, veidojas amonjaks, no kura atkal tiek sintezētas olbaltumvielas. Taču denitrifikācijas baktēriju ietekmē, kā arī degšanas procesos daļa no slāpekļa savienojumiem pārvēršas par N2. Diemžēl cilvēka darbības rezultātā šīs līdzsvars tiek traucēts, un slāpekļa daudzums augsnē samazinās. To atjauno ar kūtsmēsliem un minerālmēslojumu.
Skābekļa aprite dabā
Zaļie augi, fotosintēzes procesā sintezējot organiskās vielas, izdala skābekli. Atmosfēra zināmu skābekļa papildinājumu saņem arī tādēļ, ka tajā esošais ūdens tvaiks ultravioletā starojuma iedarbībā sadalās par ūdeņradi un skābekli:
2H2O
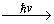 2H2 + O2
2H2 + O2
Cilvēki, dzīvnieki un arī paši augi elpošanas procesos skābekli atkal patērē, lai lēni oksidētu organiskās vielas un iegūtu sev nepieciešamo enerģiju. Ļoti daudz skābekļa patērē rūpniecībā – kurināmā sadedzināšanai, čuguna un tērauda kausēšanā, metālu attīrīšanā, metināšanā un griešanā, dažādu organisko un neorganisko vielu ražošanā utt.
Fotosintēze un degšana ir divi procesi, kas nodrošina līdzsvara saglabāšanos gaisā starp skābekli un ogļskābo gāzi. Ar to saistītie nozīmīgākie procesi ir redzami 2. attēlā.
Ogļskābās gāzes saturs gaisā ir gandrīz nemainīgs. Bet pēdējos divsimt gados ogļskābās gāzes tilpumdaļa gaisā ir palielinājies no 280 miljondaļām 1880.gadā līdz 350 miljondaļām 1990. gadā.
Ogļskābās gāzes satura palielināšanās atmosfērā samazina enerģijas daudzumu, ko Zeme atdod kosmosam. Aizvien vairāk enerģijas paliek Zemei. To sauc par siltumnīcas efektu, un tas izraisa globālo sasilšanu. Neviens zinātnieks nevar pilnīgi skaidri pateikt, kas notiks, ja ogļskābās gāzes saturs gaisā arī turpmāk palielināsies un Zemes temperatūra paaugstināsies.
Liela nozīme oglekļa apritē ir okeāniem. Zaļaļģes savos fotosintēzes procesos izlieto milzīgus daudzumus CO2.
Tātad okeāni absorbē ogļskābo gāzi, un galarezultātā tā pārvēršas par karbonātjoniem vai izgulsnējas dažādu karbonātu veidā (skat. 2.Filma).
Ūdens aprite dabā.
Ūdens ir visizplatītākā viela dabā. Zemes ūdens apvalks – hidrosfēra – veido apm. 71 % no Zemes virsmas. Ūdeņus iedala saldūdeņos un sāļūdeņos.
Saldūdens resursi uz Zemes nav lieli – 2,5 % no kopējā ūdens apjoma. Taču jāņem vērā arī nepārtrauktā ūdens aprite dabā. Piemēram, ezeru ūdens apmainās vidēji trijos gados, augsnes mitrums apmainās gada laikā, upju ūdens – 32 reizes gadā, vēl ātrāk atjaunojas atmosfēras ūdens.
Ūdenim sūcoties cauri iežiem, tas iedarbojas uz noteiktiem iežiem un minerāliem. Lietusūdens ir nedaudz skābs (pH ≈ 5,5), jo tajā izšķīdis oglekļa dioksīds. Dabā notiekošo procesu apraksta ar ķīmisko reakciju vienādojumu:
CaCO3 + H2O + CO2
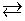 Ca(HCO3)2
Ca(HCO3)2.
| kaļķakmens
|
kalcija hidrogēnkarbonāts
|
Lietusūdenim iedarbojoties uz kaļķakmeni, izveidojas plašas pazemes alas. Kad kalcija hidrogēnkarbonāts sadalās un atkal rodas kaļķakmens, veidojas stalaktīti un stalagmīti.
 4. att. Stalagtīti un stalagmīti
4. att. Stalagtīti un stalagmīti
www.flickr.com
Tāpat lietusūdens iedarbojas uz ģipšakmeni un magnija sāļiem. Ūdeni, kurā ir izšķīduši kalcija, magnija un dzelzs (II) sāļi, sauc par cietu ūdeni.
Ūdens cietību izsaka ar Ca2+,
Mg2+ un Fe2+
jonu:
• milimolu skaitu vienā litrā ūdens - mmol/l
jeb
• molu skaitu vienā kubikmetrā ūdens – mol/m3
Ūdens cietība
1. tabula
|
Cietība, mmol/l
|
Ūdens cietība
|
| <2
|
Mīksts ūdens
|
| 2-10
|
Ciets ūdens
|
| 10<
|
Ļoti ciets ūdens
|
|
|
|
Ūdens cietība
|
|
|
|
|
Karbonātu cietība jeb pārejošā ūdens cietība
|
|
Nekarbonātu cietība jeb nepārejošā ūdens
cietība
|
|
Kopējā cietība
|
„karbonātu cietība” – Ja ūdenī izšķīduši kalcija, magnija vai dzelzs(II) hidrogēnkarbonāti.
„nekarbonātu cietība” – Ja ūdenī izšķīduši kalcija vai magnija sulfāti
vai hlorīdi.
„kopējā cietība” - Ja ūdenī izšķīduši gan kalcija, magnija hidrogēnkarbonāti,
gan sulfāti vai hlorīdi.
Tvaika katlos un siltā ūdens piegādes sistēmās lietojot cietu ūdeni, var veidoties
katlakmens, kas sastāv no CaCO3,
MgCO3, Mg(OH)2 un citām nešķīstošām vielām.
|

5. att. Katlakmens nosēdumi
www.profiltr.ru/ glossary/nakip.html
|
Cietā ūdenī slikti puto ziepes, jo kalcija un magnija joni ar tām veido nešķīstošus savienojumus.
Lai cietu ūdeni varētu izmantot, to jāmīkstina.
|
|
|
Ūdens cietības novēršanas metodes
|
|
|

|
|
Karbonātu cietība jeb pārejošā ūdens cietība
|
|
Nekarbonātu cietība jeb nepārejošā ūdens cietība
|
|
Kopējā cietība
|
1) Ūdeni vāra
Ca(HCO 3) 2
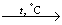 CaCO 3↓ + H 2O + CO 2↑
Mg(HCO 3) 2
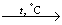 MgCO 3↓ + H 2O + CO 2↑
2) Iedarbojoties ar kalcija hidroksīdu vai nātrija karbonātu
Ca(HCO 3) 2 + Ca(OH) 2
→ 2CaCO 3↓ + 2H 2O
Ca(HCO 3) 2 + Na 2CO 3 → CaCO 3↓ + 2NaHCO 3
1) Iedarbojoties ar nātrija karbonātu
CaSO 4 + Na 2CO 3
→ CaCO 3↓ + Na 2SO 4
MgSO 4 + Na 2CO 3
→ MgCO 3↓ + Na 2SO 4
2) Izvadot cauri jonītiem 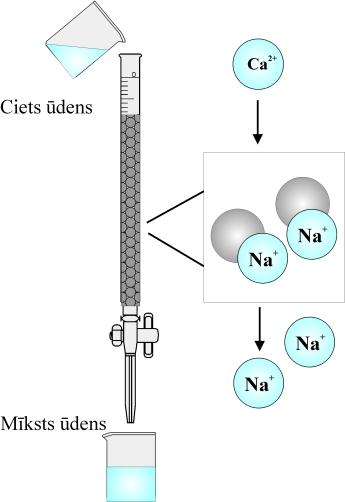
1) Iedarbojoties ar nātrija karbonātu
2) Iedarbojoties ar katjonītiem

|
Dabīgos ūdeņus piesārņo cilvēka darbības rezultātā radušās vielas, kas pārsvarā jonu veidā nonāk lietusūdenī un virszemes ūdeņos ("skābais lietus", palielināts NO3-,
PO43-
un smago metālu jonu daudzums, naftas pārstrādes produkti u. tml.).
Šādos apstākļos daudzi izstrādājumi pakāpeniski sairst. Tā rezultātā kļūst nederīgas mašīnu detaļas un dažādi instrumenti. Šādu procesu sauc par koroziju.
Visbiežāk novēro metālu koroziju. Dzelzs un tās sakausējumu koroziju ikdienā sauc par rūsēšanu.
 6. att. Metāla konstrukciju korozija
6. att. Metāla konstrukciju korozija
www.avtoplastik.ru/ antikor_in.htm
Korozija - metālu un to sakausējumu sairšana, ko izraisa vielas, kas atrodas apkārtējā vidē.
Pēc norises mehānisma izšķir divus metālu korozijas veidus: ķīmiskā korozija un
elektroķīmiskā korozija.
Ķīmiskā korozija – apkārtējā vidē esošo vielu (O
2,
N
2, H
2S, H
2,
u.c.) oksidējoša iedarbība uz metāliem un to sakausējumiem.
Piemēram, sudraba priekšmeti ar laiku kļūst tumši, jo notiek ķīmiska reakcija starp sudrabu un gaisā esošām gāzēm:
4Ag + 2H2S + O2 → 2Ag2S↓ + 2H2O
Elektroķīmiskā korozija – metālu un to sakausējumu sairšana apkārtējā vidē esošo elektrolītu iedarbības rezultātā.
Mitrums uz metāla virsmas veido elektrolīta šķīdumu. Ūdens slānītī izšķīst atmosfērā esošās gāzes – O2, CO2, SO2, H2S,
u.c. Šķīdumam ir neitrāla, skāba vai bāziska vide.
Metāli satur citu metālu piemaisījumus. Aktīvākais metāls sairst, jo notiek oksidēšanās process, kura rezultātā metāla joni pāriet šķīdumā:
Me – ne- → Men+
Atkarībā no šķīduma vides noris ūdeņraža jonu vai ūdenī izšķīdušā skābekļa reducēšana:
skābā vidē: 2H+ + 2e- → H2↑ ;
neitrālā vai bāziskā vidē: O2
+ 2H2O + 4e- → 4OH-
|
|
|
Svarīgākās metodes metālu aizsardzībai pret koroziju |
|
|

|
|
Metālu virsmas pārklāšana ar aizsargkārtu
|
|
Pret koroziju izturīgu sakausējumu izgatavošana |
|
Elektroķīmisko aizsardzības metožu izmantošana |
|
Vides sastāva mainīšana |
Metālu virsmas pārklāšana ar aizsargkārtu:
• ar citiem metāliem
Anodpārklājums
Metāla konstrukciju pārklāj ar aktīvāku metālu. Korodē aktīvākais metāls, pat tad, ja pārklājums ir bojāts
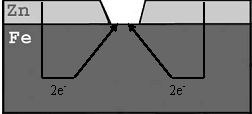
11. att. Anodpārklājums
Katodpārklājums
Metāla konstrukciju pārklāj ar mazāk aktīvu metālu, kas vairāk izturīgs pret koroziju. Ja pārklājums bojāts, korodē pati metāla konstrukcija.
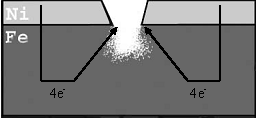
12. att. Katodpārklājums
• ar laku, krāsu vai emalju
• ar dažādām eļļām
Pret koroziju izturīgu sakausējumu izgatavošana
Nerūsošais tērauds.
Elektroķīmisko aizsardzības metožu izmantošana
Katodaizsardzība
Metāla konstrukciju pievieno pie līdzstrāvas avota negatīvā pola. Metāla konstrukcija kļūst par katodu. Strāvas avota pozitīvajam polam pievieno dzelzs lūžņu gabalus. Dzelzs lūžņi pārvēršas par anodu. Korodē lūžņi, bet metāla konstrukcija tiek aizsargāta pret koroziju.
Protektoraizsardzība
Aizsargājamo metāla konstrukciju savieno ar aktīva metāla (Zn, Al, Mg) sakausējuma plāksni, ko sauc par protektoru. Protektors sairst, tāpēc tas periodiski jānomaina.
Vides sastāva mainīšana
• inhibitoru izmantošana.
Inhibitori ir vielas, kas palēnina vai pārtrauc ķīmisko reakciju norisi.
• vides deaerācija.
|