Karbonskābes ir ogļūdeņražu atvasinājumi, kuru molekulās ogļūdeņraža atlikums saistīts ar karboksilgrupu.
Karbonskābju vispārīgā formula.
Karbonskābju iedalījums un nomenklatūra
1. tabula
|
Pēc ogļūdeņraža atlikuma
|
Pēc karboksilgrupu skaita
|
|
Piesātinātās
|
Nepiesātinātās
|
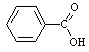
Aromātiskās
|
Vienvērtīgās
|
Vairākvērtīgās
|
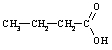
|
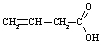
|
|
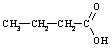
|
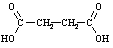
|
Pēc IUPAC nomenklatūras karbonskābes oglekļa atomu skaitam atbilstošajam ogļūdeņraža nosaukumam pievieno vārdu skābe. Taču ļoti daudzu karbonskābju nosaukumi veidojušies vēsturiski.
Karbonskābju nosaukumi
2. tabula
Skudrskābe pirmo reizi iegūta jau 17. gs., destilējot sarkanās skudras ar ūdens tvaiku.
Etiķskābe jeb „vīna etiķis” – šis vārds atvasināts no sena franču vārda „vin aigre”, kas nozīmē „skābais vīns”. 1864. gadā Luijs Pastērs pierādīja , ka etiķskābes rašanās ir fermentatīvs process.
Tīra etiķskābe sacietē 16,5 °C temperatūrā, veidojot ledum līdzīgus kristālus. Tāpēc 100% etiķskābi sauc arī par ledus etiķskābi. 60–70% etiķskābes šķīdumu sauc par etiķa esenci, 5–9% – par galda etiķi, 3–6% pārtikas etiķi sauc arī par vīna etiķi.
Sviestskābe dabā sastopama esteru veidā sviesta sastāvā.
Baldriānskābe dabā sastopama baldriāna saknēs.
Palmitīnskābe dabā sastopama glicerīna esteru veidā taukos. Ļoti daudz palmitīnskābes ir cūku un liellopu tauku sastāvā esošajos esteros.
Oleīnskābe dabā sastopama glicerīna esteru veidā augu eļļās, piemēram, olīveļļa satur 70–85% glicerīna trioleāta.
Benzoskābe pirmoreiz iegūta no dabas produktiem – benzosveķiem.
Skābeņskābe dabā sastopama daudzos augos (skābenēs, rabarberos, zaķkāpostos) skābo sāļu veidā (K, Ca sāļi). Dažu vielmaiņas procesu traucējumu gadījumos tā sastopama arī cilvēka urīnā.
Karbonskābju fizikālās īpašības
Karbonskābju fizikālās īpašības atkarīgas no oglekļa atomu skaita molekulā:
a) C1–C3
– šķidrumi
ar kodīgu smaržu;
b) C4–
C8
– smarža kļūst arvien nepatīkamāka;
c) C15 – C18 – kristāliskas vielas ar vāju stearīna smaržu.
Karbonskābju fizikālās īpašības
3. tabula
|
Skābe |
Viršanas temperatūra, ºC
|
Kušanas temperatūra, ºC
|
Blīvums, g/cm3
|
Šķīdība ūdenī
|
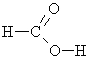
metānskābe
|
100 |
8.3 |
1,22 |
∞
|
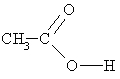
etānskābe
|
118 |
16,5 |
1,05 |
∞ |
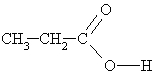
propānskābe
|
141 |
-21 |
0,99 |
∞ |
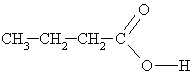
butānskābe
|
164 |
-5 |
0.96 |
∞ |
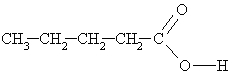
pentānskābe
|
187 |
34 |
0,94 |
5,0 |
Palielināt.
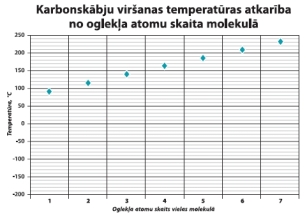 1. att. Karbonskāblu viršanas
1. att. Karbonskāblu viršanas
temperatūras atkarība no oglekļa atomu skaita.
Starp karbonskābju ar mazu oglekļa atomu skaitu molekulu karboksilgrupām veidojas ūdeņražsaites.
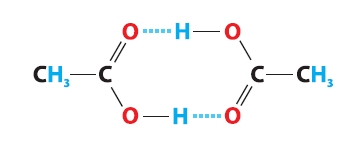
Tāpēc virknē: ogļūdeņraži – spirti – aldehīdi – karbonskābes, karbonskābēm ir visaugstākā viršanas temperatūra.
Organisko vielu viršanas temperatūras, °C
4. tabula
|
Oglekļa atomu skaits molekulā |
Ogļūdeņradis
|
Spirts
|
Aldehīds
|
Karbonskābe
|
|
1 |
-161 |
64,7 |
-19 |
100,8 |
|
2 |
-88,6 |
78,4 |
20 |
118,1 |
|
3 |
-44,5 |
97 |
47 |
141,1 |
Palielināt.
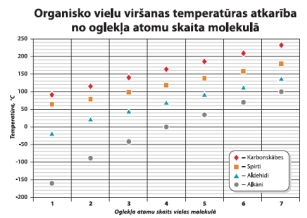 2. att. Organisko vielu viršanas temperatūras
2. att. Organisko vielu viršanas temperatūras
atkarība no oglekļa atomu skaita.
Karbonskābju ķīmiskās īpašības
CH3COOH + NaOH → CH3COONa + H2O
2CH3COOH + Mg → (CH3COO)2Mg + H2
2CH3COOH + Na2CO3
→ 2CH3COONa + CO2 + H2O
2CH3COOH + Cu(OH)2 → (CH3COO)2Cu + 2H2O
HCl + NaOH → NaCl + H2O
2HCl + Mg → MgCl2 + H2
2HCl + Na2CO3 → 2NaCl + H2O
+ CO2
2HCl + Cu(OH)2 → CuCl2 + 2H2O