2.3. Vielu šķīdība ūdenī
Dažas vielas ūdenī šķīst ļoti labi, citas šķīst sliktāk vai nešķīst gandrīz nemaz. Ir vielas, kuras ūdenī sadalās (Neorganisko sāļu, bāzu un skābju šķīdība ūdenī). Vielas šķīšanas kvantitatīvai raksturošanai lieto lielumu "šķīdība". Šķīdība ir vielas masa gramos, kas noteiktā temperatūrā spēj izšķīst 100 gramos šķīdinātāja, veidojot piesātinātu šķīdumu. Vielu šķīdība ir atkarīga no temperatūras. To grafiski attēlo, izmantojot sāļu šķīdības līknes un gāzu šķīdības līknes.
Pēc šķīdības līknes iespējams noteikt vielas šķīdību noteiktā temperatūrā. Izmantojot šķīdības līknes, var noteikt šķīduma veidu – piesātināts šķīdums, nepiesātināts šķīdums vai pārsātināts šķīdums.
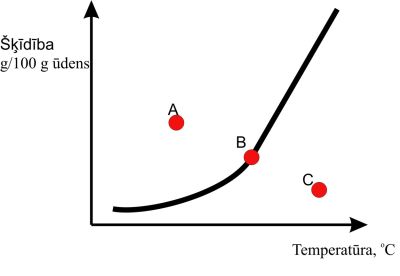
3.att. Šķīdības līknes.
|
A – pārsātināts šķīdums
B – piesātināts šķīdums
C – nepiesātināts šķīdums
|
Šķīdumu, kurā šķīdināmā viela dotajā temperatūrā vairs nešķīst, sauc par piesātinātu šķīdumu.
Šķīdumu, kurā šķīdināmo vielu dotajā temperatūrā vēl var izšķīdināt, sauc par nepiesātinātu šķīdumu.
Pārsātināts ir šķīdums, kas dotajā temperatūrā satur vairāk izšķīdušās vielas nekā nepieciešams, lai šķīdums būtu piesātināts.