3. uzdevums
Cik gramu kristāliskās sodas Na2CO3·10H2O nepieciešams, lai pagatavotu 200 ml 0,3 M nātrija karbonāta šķīduma?
Atrisinājums
a) Nosaka dotos lielumus, bet pēc tam lielumus, kas jāaprēķina.
Dotie lielumi: V = 200 ml, c = 0,3 mol/l,
Nezināmais lielums: n (mol)
Tālāk
b) Aprēķina, cik liels daudzums izšķīdušās vielas ir šķīdumā, izmantojot formulu:
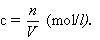 Atceries, ka tilpums jāpārveido litros!
Atceries, ka tilpums jāpārveido litros!
n(Na2CO3)
= c ·V = 0,3 mol/l · 0,2 l = 0,06 mol.
Tālāk
c) Aprēķina kristālhidrāta daudzumu.
n(Na2CO3)
= n(Na2CO3 · 10H2O)
= 0,06 mol.
Tālāk
d) Aprēķina kristālhidrāta molmasu.
M(Na2CO3 · 10H2O)
= 23 g/mol · 2 + 12 g/mol + 16 g/mol· 3 + 1 g/mol · 20 + 16 g/mol · 10 = 286 g/mol
Tālāk
e) Aprēķina kristālhidrāta masu, kas nepieciešama šķīduma pagatavošanai.
m(Na2CO3 · 10H2O)
= n · M = 0,06 mol · 286 g/mol = 17 g
Atbilde. Šķīduma pagatavošanai nepieciešami 17g Na
2CO
3 · 10H
2O.