6.3. Atomu savienošanās secība un izomērija
Ogleklis veido ievērojami lielāku savienojumu skaitu nekā citi ķīmiskie elementi. To var izskaidrot ar oglekļa atoma uzbūvi.
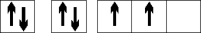
a) Pamatstāvoklī
+6C 1s2 2s2
2p2
|
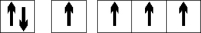
b) Ierosinātā stāvoklī
+6C 1s2 2s1
2p3
|
|
|
Ierosinātā stāvoklī ogleklim ir 4 nesapāroti elektroni,
tāpēc ogleklis spēj piedalīties 4 kopīgu elektronu pāru (4 kovalento saišu) veidošanā gan ar citiem oglekļa atomiem, gan arī ar skābekli, slāpekli, sēru, fosforu, halogēniem, kā arī metālu atomiem.
Oglekļa atomi var veidot nesazarotas, sazarotas un cikliskas virknes.
Molekulformulas C4H10 gadījumā var uzrakstīt divas struktūrformulas, kas atbilst divām dažādām vielām ar atšķirīgām fizikālajām īpašībām.
Oglekļa atomu virknes izomērija
3. tabula
CH3-CH2-CH2-CH3
Viršanas temperatūra –1°C
|
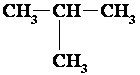
Viršanas temperatūra –10°C
|
Parādība, kad vielām, kurām ir vienāds sastāvs, ir atšķirīga uzbūve un īpašības,
ir izomērija.