2. uzdevums
Iekšējā enerģija.
|
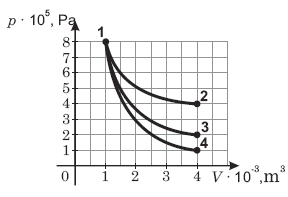
Attēlā parādīta nemainīgas masas ideālās vienatomu gāzes stāvokļa maiņa – no stāvokļa 1 uz stāvokļiem 2, 3 un 4.
Aizpildi tabulu un atbildi uz jautājumiem!
- Kā mainās gāzes iekšējā enerģija?
- Kurš no grafiski attēlotajiem procesiem ir izotermisks process?
|
Stāvokļi
|
1 |
2 |
3 |
4 |
|
p · 105,
Pa
|
|
|
|
|
|
V · 10-3, m3
|
|
|
|
|
|
U, kJ
|
|
|
|
|
Iekšējās enerģija
izmaiņa
|
|
|
|
|
Atrisinājums
Gāzes iekšējā enerģija ir atkarīga no gāzes absolūtās temperatūras: U ~ T (vienatomu gāzes iekšējā enerģija)
Gāzes stāvokļa maiņa attēlota
pV koordinātās. Ideālās gāzes stāvokli var aprakstīt ar Mendeļejeva – Klapeirona vienādojumu:
Tālāk
No grafika nolasa spiediena un tilpuma vērtības katrā no ideālās vienatomu gāzes stāvokļiem un aprēķina iekšējo enerģiju. Iegūtos rezultātus apkopo tabulā:
|
Stāvokļi
|
1 |
2 |
3 |
4 |
|
p · 105,
Pa
|
8,0 |
4,0 |
2,0 |
1,0 |
|
V · 10-3, m3
|
1,0 |
4,0 |
4,0 |
4,0 |
|
U, kJ
|
1,2 |
2,4 |
1,2 |
0,6 |
Iekšējās enerģija
izmaiņa
|
sākuma stāvoklis |
palielinājusies |
nav mainījusies |
samazinājusies |
Tālāk
Atbilde
Izotermiskā procesā gāzes iekšējā enerģija nemainās. Tabulā
redzams, ka izotermisks process ir 1→ 3.