1. uzdevums
Ūdeņraža atoms
|
Elektrona orbītas diametrs ūdeņraža atomā ir 0,1 nm. Aprēķini pievilkšanās spēku starp elektronu un kodolu ūdeņraža atomā.
Atrisinājums
Mijiedarbības spēku starp lādētām daļiņām var aprēķināt, izmantojot Kulona likumu
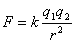
,
kur k = 9,0·109 (N·m2)/C2 – konstante Kulona likumā,
q1 un q2 – daļiņu lādiņi,
r – attālums starp lādētajām daļiņām.
Tālāk
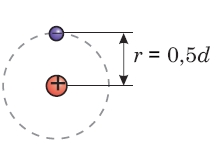
Ūdeņraža atoms
|
Attālums starp protonu un neitronu ir r =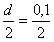 =
0,05 nm = 5,0 · 10-11 m.
=
0,05 nm = 5,0 · 10-11 m.
Protona lādiņš: q1
= 1,6 · 10-19 C. Elektrona
lādiņš: q2 = –
1,6 · 10-19 C.
Tālāk
Pieraksta dotos lielumus, aprēķinu formulu un aprēķina mijiedarbības spēku.
Jāatceras, ka jāaprēķina Kulona spēka modulis, tāpēc aprēķinos izmanto elektrona lādiņa moduli.
Tālāk
k = 9,0·109 (N·m2)/C2
r = 0,05 nm
q1 = 1,6 · 10-19 C
q2 = – 1,6 · 10-19 C
|
|
|
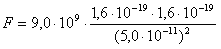 ≈ 9,0·10 -8 N
|
F – ?
Tālāk |
|
Atbilde
Ūdeņraža atomā elektrons un kodols savstarpēji pievelkas ar aptuveni 9,0 · 10-8 N spēku.